La Cofepris autoriza registros de Pfizer y Moderna para sus dosis antiCOVID en México
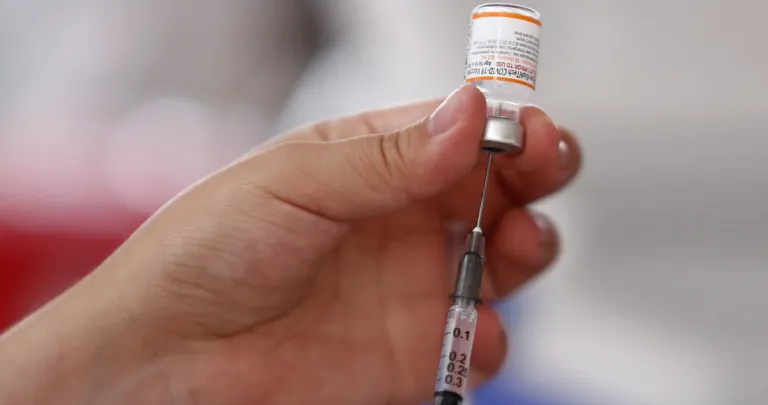
Casi dos meses después de la solicitud que los laboratorios Pfizer y Moderna realizaron para la obtención del registro sanitario de sus vacunas contra la COVID-19, la Cofepris autorizó el registro y la venta de los biológicos en el mercado nacional.
Los laboratorios Pfizer y Moderna obtuvieron el registro sanitario que permitirá la incorporación de las vacunas Comirnaty y Spikevax (monovalente XBB.1.5) al mercado nacional.
En un comunicado, la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) informó que un equipo multidisciplinario de personal federal determinó que “los biológicos de Pfizer y Moderna cumplieron los requisitos de calidad, seguridad y eficacia” para obtener el Registro Sanitario de vacunas contra COVID-19.
“La determinación simultánea para expedir registro sanitario a vacunas contra COVID-19, permitiendo su comercialización en México, sienta precedente hacia una regulación enfocada en garantizar el acceso sin beneficiar a ningún usuario en particular, y eliminando la necesidad de intermediario o gestor”, declaró la Cofepris.
Anteriormente, los biológicos únicamente tenían una autorización de uso de emergencia, en el marco de la pandemia que alcanzó al país desde el 2020 hasta que se declaró su término en marzo de 2023.
En aquel momento, el permiso fue revocado e inició el trámite para la obtención de un registro sanitario que permitiera la venta de los biológicos. A partir de entonces, la Cofepris solicitó a los laboratorios la documentación necesaria para obtener el permiso.
El pasado 29 de noviembre, la Cofepris informó que ambas empresas requirieron mayor tiempo para presentar los elementos e información técnica faltante en el expediente que ingresaron para obtener el trámite; misma que habría sido presentada en la fecha pactada y resultó en la obtención del permiso.
Los registros emitidos por Cofepris serán vigentes “en la medida que dichos medicamentos e insumos sean necesarios para dar continuidad a la Política Nacional de Vacunación para la prevención de COVID-19 en México, o bien para el plan de gestión de largo plazo que determine la Secretaría de Salud”, estableció la Comisión.
Sin embargo, las autoridades hicieron un llamado a la ciudadanía a no hacer uso indiscriminado de ninguna vacuna contra COVID-19, pues debe considerarse el riesgo-beneficio de cada aplicación.
“El registro de estos biológicos debe ser bajo vigilancia médica y no se deberá aplicar de manera indiscriminada, ya que pueden representar riesgos para la salud”, advirtió la Cofepris.
Anteriormente, el 14 de octubre de este año, la Cofepris anunció que recibió un total de cuatro solicitudes, procedentes de tres empresas farmacéuticas distintas, interesadas en obtener el registro sanitario necesario para la comercialización de vacunas contra la COVID-19 en el mercado nacional.
Se trató de las vacunas Comirnaty de Pfizer; Vaxzevria de AstraZeneca; Spikevax de ModernaTx, y Spikevax bivalente de ModernaTx (estas dos últimas vacunas, a través de su representante legal en México; Asofarma S.A. de C.V.).
En distintas sesiones, las vacunas fueron evaluadas por el Comité de Moléculas Nuevas (CMN), que emitió una opinión pública que es posible consultar en las redes sociales de la Comisión.
Cabe mencionar que dicho Comité es la instancia de consulta que emite la opinión técnica sobre la seguridad, calidad y eficacia de diferentes insumos para la salud. Sin embargo, dichas opiniones no son vinculantes finales para la autorización y distribución por la Cofepris.
Crédito: SINEMBARGO




